

 Задачи с решениями
Задачи с решениями

Определите молярную теплоемкость углекислого газа (CO2) в процессе, в котором давление изменяется пропорционально объему
Углекислый газ состоит из трехатомных молекул. Следовательно, его молярная теплоемкость в процессе с постоянным объемом
Искомая теплоемкость равна
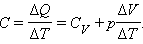
Чтобы найти выражение 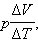 продифференцируем уравнение состояния
продифференцируем уравнение состояния
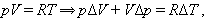
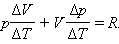
Но из уравнения процесса вытекает:
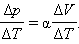
Следовательно,
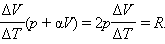
Искомая теплоемкость равна
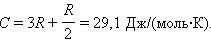
Задача может быть решена и другим, графическим способом. Изобразим процесс
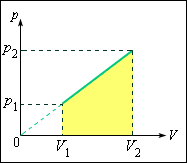 |
| Рисунок 3.10.1.
|
Пусть на некотором участке процесса объем изменяется от
Работу газа рассчитаем с помощью графика
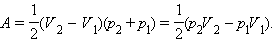
Из уравнения состояния 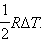 Отсюда следует:
Отсюда следует:
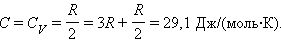
 1 из 2
1 из 2
 |
Главная Бесплатные онлайн учебники Бесплатная подготовка по всем предметам онлайн |
||
|
© Физикон, 1999-2026 E-mail: |
||
|
|
||