

 Задачи с решениями
Задачи с решениями

Рассчитайте изменение энтропии при расширении моля идеального газа «в пустоту» от первоначального объема
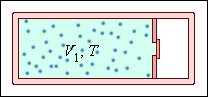 |
| Рисунок 3.12.1.
|
Начальная температура газа
Газ расширяется «в пустоту» без совершения работы и без теплообмена с окружающими телами. Следовательно, его внутренняя энергия не изменяется. Так как внутренняя энергия идеального газа зависит только от температуры, температура газа в конечном состоянии такая же, как и в начальном. Для вычисления изменения энтропии газа необходимо рассмотреть некоторый квазистатический процесс перехода системы из начального состояния в конечное. В данном случае можно рассмотреть процесс квазистатического изотермического расширения газа (
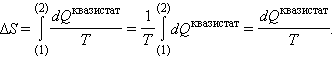
При изотермическом процессе
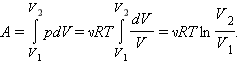
Следовательно,
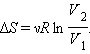
Подставляя числовые данные, получим
В процессе необратимого расширения газа «в пустоту» энтропия возрастает.
 2 из 2
2 из 2
 |
Главная Бесплатные онлайн учебники Бесплатная подготовка по всем предметам онлайн |
||
|
© Физикон, 1999-2026 E-mail: |
||
|
|
||